创新药又迎重大利好,符合要求的创新药临床试验申请审评审批时限,有望由60个工作日缩短为30个工作日。
16日,为落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)有关要求,支持创新药研发,国家药监局发布了《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》,向社会公开征求意见。
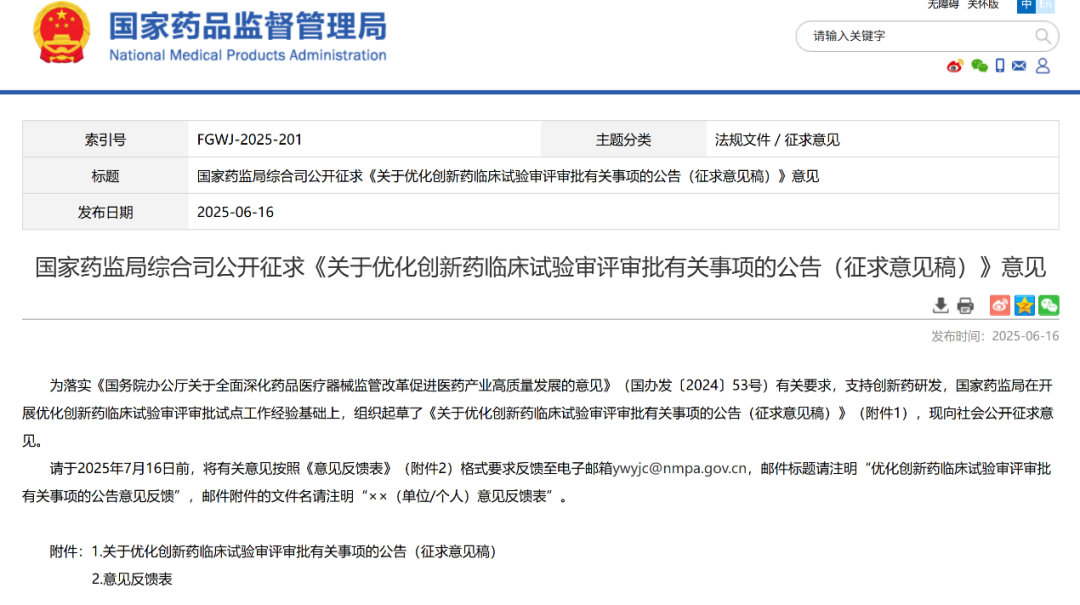
征求意见稿提出:
为进一步支持以临床价值为导向的创新药研发,提高临床研发质效,对符合要求的创新药临床试验申请在30个工作日内完成审评审批。
药物临床试验申请审评审批30日通道支持国家重点研发品种,鼓励全球早期同步研发和国际多中心临床试验,服务临床急需和国家医药产业发展。
纳入创新药临床试验审评审批30日通道的申请,应当为中药、化学药品、生物制品1类创新药,能够按要求提交申报资料,并需满足以下条件之一:国家支持的重点创新药;入选国家药品监督管理局药品审评中心儿童药星光计划、罕见病关爱计划的品种;全球同步研发品种。
对比发现,在2025年1月对外发布的《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》中,明确提出了“优化临床试验审评审批机制”的相关措施,即“省级药品监管部门提出申请,国家药监局同意后,在部分地区开展优化创新药临床试验审评审批试点,将审评审批时限由60个工作日缩短为30个工作日。医疗器械临床试验审评审批时限由60个工作日缩短为30个工作日”。
显然,此次征求意见稿中提到的“对符合要求的创新药临床试验申请在30个工作日内完成审评审批”,是对此前相关试点在全国的进一步推广,将显著缩短审评审批的时间,加快创新药的研发进度。
(来源:中国经济网)
(编辑:草脑日;校对:霍晓霞;一读:张飞;一审:张燕青;二审:贾星慧;三审:王睿)